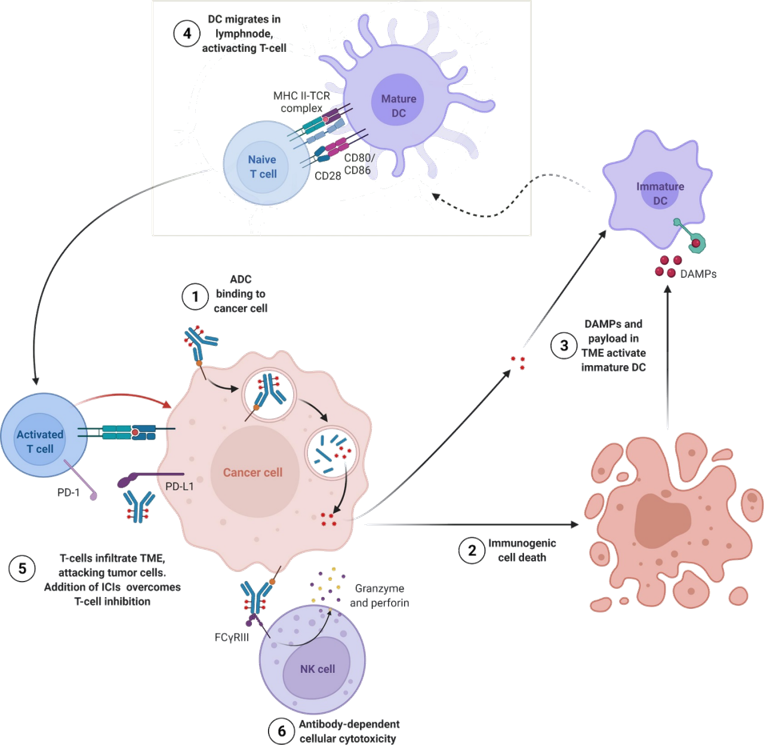
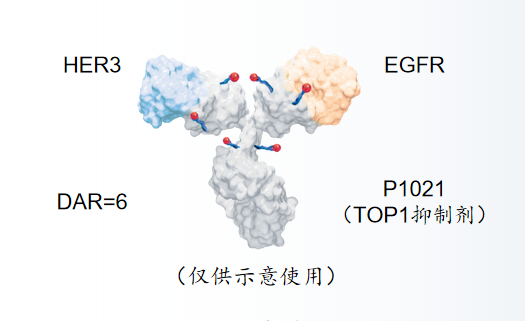
药物设计的主要亮点
经过验证的机制,拥有差异化的分子设计
・差异化“1+1”形式设计
・在EGFR耐药、EGFR低表达或HER3耐药模型中展现出更佳疗效
・与传统的单特异性ADC相比,提高了治疗效果
基于对生物学深刻理解的独特设计
・对肿瘤细胞的结合亲和能力高于健康细胞
・更好的内吞性,增强对肿瘤的有效载荷
各种设计策略
・TAA+I0(DB-1419)-同时靶向(i)肿瘤细胞上的TAA,以诱导肿瘤细胞死亡;及(ii)10抗原,以利用免疫系统实现协同效果
・TAA+TAA(DB-1418)-靶向两种不同且经优化选择的TAA.该等TAA在相同的癌细胞中共同表达,以改善抗肿瘤疗效,并降低脱靶毒性